Stan równowagi dynamicznej jest opisywany przez prawo działania mas Guldberga i Waagego. Mówi ono, że w stanie równowagi stosunek iloczynu stężeń produktów (podniesionych do potęg ich współczynników stechiometrycznych z równania reakcji) do iloczynu stężeń substratów (również w potęgach ich współczynników stechiometrycznych) jest wielkością stałą, charakterystyczną dla danej reakcji odwracalnej w danej temperaturze oraz w danym ciśnieniu. Wielkość ta nazwana jest stałą równowagi reakcji.
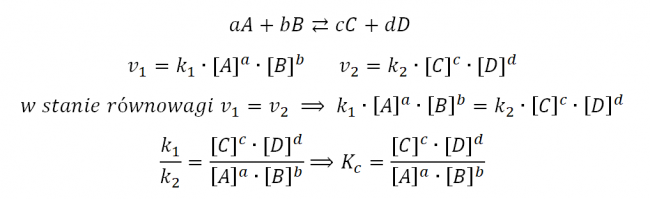
Gdzie Kc to stężeniowa stała równowagi, a [A], [B], [C], [D] to stężenia reagentów w stanie równowagi.
Dla reakcji przebiegających w stanie gazowym zamiast stężeń mogą być podstawione ciśnienia gazowych reagentów.
Stała równowagi jest zależna od temperatury i ciśnienia (dla reakcji w fazie gazowej), jednak nie zależy od stężeń początkowy substratów. Dla reakcji endoenergetycznych stała równowagi rośnie ze wzrostem temperatury, natomiast dla reakcji egzoenergetycznych maleje ze wzrostem temperatury.
Ważne: we wzorze na stałą równowagi nie uwzględnia się ciał stałych.