Według Arrheniusa kwasem jest substancja, która dysocjuje w roztworze wodnym z odszczepieniem jonów \(H^+\), zasadą nazywamy substancją, która dysocjuje roztworze wodnym z odszczepieniem jonów \(OH^-\).
Przykłady kwasów wg Arrheniusa: \(HCl\), \(HNO_2\), \(HNO_3\), \(H_2SO_4\), \(HBr\), \(H_3COOH\), \(H_2CO_3\)
Przykłady zasad wg Arrheniusa: \(NaOH\), \(KOH\), \(Ca(OH)_2\), \(Mg(OH)_2\)
Zoobojętninie polega na utworzeniu cząsteczki wody w reakcji jonów \(H^+\)oraz jonów \(OH^-\).
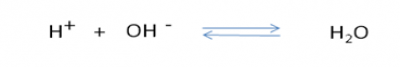
Zadanie:
Napisz reakcje dysocjacji:
\(H_2SO_4\), \(HBr\), \(H_3COOH\), \(KOH\), \(NaOH\)
Odpowiedź:
Kwasy wieloprotonowe takie jak \(H_2SO_4\) dysocjują wieloetapowo:
\(H_2SO_4 \Leftrightarrow H^++HSO_4^-\)
\(HSO_4^- \Leftrightarrow H^++SO_4^{2-\)
Kwasy jednoprotonowe dysocjują jednoetapowo:
\(HBr \Leftrightarrow H^++Br ^{-} \)
\(H_3COOH \Leftrightarrow H_3COO^-+H^+\)
zasady też ulegają dysocjacji:
\(NaOH \Leftrightarrow Na^++OH^-\)
\(KOH \Leftrightarrow K ^{+}+OH^- \)