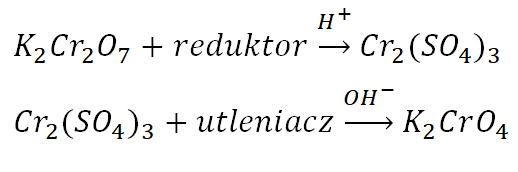Chrom jest metalem przejściowym, pierwiastkiem bloku d. Przyjmuje dość szeroki zakres stopni utlenienia (od II do VI). Wynika to z charakterystycznego rozmieszczenia jego elektronów walencyjnych na podpowłokach elektronowych. Konfiguracja elektronowa manganu wygląda następująco:
24Cr 1s22s22p63s23p64s13d5
Pogrubioną czcionką zaznaczono elektrony walencyjne. Nietypowa konfiguracja chromu wynika z promocji elektronowej, która sprawia, że posiada on 5, a nie 4 elektrony niesparowane (konfiguracja 4s13d5 zamiast 4s23d4). Najważniejszymi stopniami utlenienia chromu są II, III i VI. Wraz ze wzrostem stopnia utlenienia charakter tlenków chromu zmienia się od zasadowego, przez amfoteryczny po kwasowy:
| Stopień utlenienia | CrII | CrIII | CrVI | |
| Wzór tlenku | CrO | Cr2O3 | CrO3 | |
| Charakter tlenku | zasadowy | amfoteryczny | kwasowy | |
| Przykładowe jonu i związki |
Cr2+ CrCl2 |
Cr3+ | CrO42- K2CrO4 | Cr2O72- K2Cr2O7 |
| Właściwości |
Związki CrII są nietrwałe, łatwo ulegają utlenieniu (są reduktorami) |
Związki CrIII mogą ulegać utlenieniu i redukcji (są utleniaczami i reduktorami) |
Związki CrVI łatwo się redukują (są dobrymi utleniaczami) |
|
| Kolor | niebieski | zielony | żółty | pomarańczowy |
| -- wzrost właściwości utleniających --> | ||||
Tworzone przez chrom (VI) chromiany i dichromiany wykazują różną trwałość, w zależności od pH środowiska. W środowisku kwaśnym trwalsze są dichromiany, natomiast w środowisku zasadowym chromiany (VI). Co ważne K2Cr2O7 wykazuje najsilniejsze właściwości utleniające w środowisku kwasowym a Cr2(SO4)3 najsilniejsze właściwości redukujące w środowisku zasadowym: