Zapoznaj się z rysunkiem i wskaż roztwór o najwyższej i najniższej temperaturze krzepnięcia
W roztworach substancji nielotnych obserwujemy efekt krioskopowy, polegający na obniżeniu temperatury krzepnięcia roztworu względem czystego rozpuszczalnika. Obniżenie temperatury jest proporcjonalne do ilości cząsteczek rozpuszczonych, nie zależy jednak od rodzaju rozpuszczanej substancji.
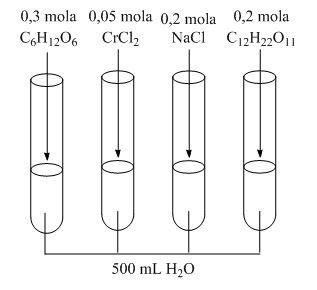
Zapoznaj się z poniższym rysunkiem, a następnie wskaż probówkę, w której roztwór ma najwyższą i najniższą temp. krzepnięcia. Odpowiedź uzasadnij. Podaj jeden przykład wykorzystania efektu krioskopowego w życiu codziennym.
Odpowiedź eSzkola.pl
Aby móc porównać efekt krioskopowy należy uprzednio obliczyć stężenia jonów lub cząstek w każdej z probówek:
C1 = n/V = 0,3/0,5 = 0,6 mol/dm3 C6H12O6
C2 = 0,05/0,5 = 0,1 mola/dm3 CrCl2
Ponieważ chlorek chromu(II) dysocjuje w wodzie na 1 kation Cr2+ i 2 aniony Cl-, stężenie jonów wynosi 0,1×3 = 0,3 mol/dm3
C3 = 0,2/0,5 = 0,4 mol/dm3
Stężenie jonów w roztworze wynosi 0,8 mol/dm3
C4 = 0,2/0,5 = 0,4 mol/dm3
Odpowiedź: Najwyższą temperaturę krzepnięcia będzie miała probówka chlorkiem chromu(II), ponieważ stężenie jonów jest najmniejsze, natomiast najniższą roztwór chlorku sodu, gdyż w roztworze znajduje się najwięcej jonów.
Efekt krioskopowy jest wykorzystywany zimą podczas posypywania jezdni NaCl – zapobiega to zamarzaniu stopionego śniegu.