Można wyróżnić następujące rodzaje reakcji chemicznych, którym ulegają alkohole: substytucji nukleofilowej, eliminacji, estryfikacji, uwodornienia (redukcji) oraz utleniania. W reakcjach tych, z alkoholi można otrzymać odpowiednio – halogenki alkilowe, alkeny, estry, alkany oraz aldehydy, aldehydy albo ketony, a także kwasy karboksylowe.
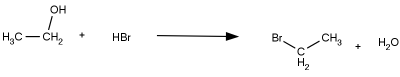
Reakcje substytucji nukleofilowej alkoholi zachodzą zazwyczaj w środowisku kwaśnym, ponieważ wymagają przyłączenia protonu do grupy hydroksylowej, aby ułatwić jej oderwanie od cząsteczki. Środowisko kwaśne może zapewnić np. obecność kwasu halogenowodorowego, dlatego metoda ta jest skuteczna na przykład dla bromoalkanów. Przykładową reakcją tego typu jest reakcja otrzymywania bromoetanu z etanolu (schemat poniżej).
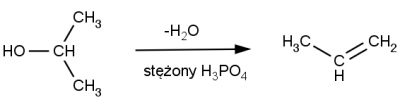
W reakcjach eliminacji, z alkoholi powstają alkeny. Podobnie jak reakcje substytucji nukleofilowej, reakcje eliminacji wymagają kwaśnego środowiska, które ułatwia oderwanie grupy hydroksylowej. Reakcje eliminacji i substytucji nukleofilowej na ogół biegną konkurencyjnie, przewaga produktu alkenowego lub halogenku zależy od warunków reakcji. Przykładową reakcję eliminacji pokazano poniżej.
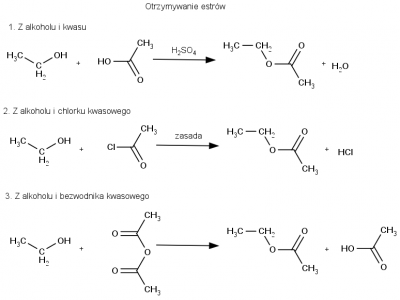
Estryfikacja alkoholi może zachodzić z wykorzystaniem różnych odczynników: kwasów karboksylowych, bezwodników kwasowych lub chlorków kwasowych. Produktem reakcji zawsze jest odpowiedni ester, natomiast różne są produkty uboczne – woda w przypadku reakcji z kwasem, wolny kwas organiczny w reakcji z bezwodnikiem i chlorowodór w reakcji z chlorkiem kwasowym. Różne warianty estryfikacji na przykładzie otrzymywania octanu etylu, przedstawiono na schemacie poniżej.
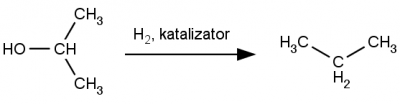
Uwodornienie alkoholi prowadzi do alkanów, do przeprowadzenia tej reakcji wykorzystuje się gazowy wodór w obecności katalizatora metalicznego (czerń platynowa, pallad na węglu aktywnym lub nikiel Raney’a). Przykładową reakcję przedstawiono poniżej.
Produkty reakcji utleniania alkoholi zależą od rzędowości utlenianego alkoholu. Alkohole pierwszorzędowe utleniają się do aldehydów, a następnie bardzo łatwo do kwasów karboksylowych, natomiast alkohole drugorzędowe utleniają się do ketonów (dalsze utlenianie jest trudne, wiązałoby się z rozpadem cząsteczki). W przypadku alkoholi trzeciorzędowych – utlenianie zachodzi tylko w bardzo drastycznych warunkach (silny utleniacz, bardzo wysoka temperatura), z rozerwaniem łańcucha węglowego i fragmentacją cząsteczki alkoholu. Ogólny schemat procesu utleniania alkoholi przedstawiono poniżej. Przykładowymi czynnikami utleniającymi mogą być: nadmanganian potasu lub tlenek chromu(VI) w środowisku kwaśnym (silne utleniacze), czy też nadtlenek wodoru albo podchloryn sodu, NaClO – łagodniejsze utleniacze.

Alkohole reagują również z aktywnymi metalami takimi jak sód czy potas, dając alkoholany:
![]()
Reakcją, która służy do identyfikacji rzędowości alkoholi jest tzw. próba Lukasa. Polega ona na reakcji alkoholu z fluorowcowodorem (np. kwasem solnym) w obecności chlorku cynku lub wapnia (ZnCl2 lub CaCl2). Jako objaw reakcji obserwuje się zmętnienie roztworu. Najszybciej mętnieją alkohole trzecio-, następnie drugo- a najwolniej pierwszorzędowe.
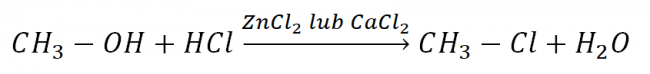
Alkohole w środowisku kwaśnym mogą reagować również ze sobą, dając etery:
![]()