Substytucja elektrofilowa to najważniejszy rodzaj reakcji, którym ulegają związki aromatyczne. W reakcji substytucji, atom wodoru przy układzie aromatycznym ulega wymianie na fragment o charakterze elektrofilowym. Ogólny mechanizm substytucji pokazany jest na schemacie poniżej: dodatnio naładowany elektrofil przyłącza się do jednego z atomów węgla w układzie aromatycznym, w efekcie powstaje nie-aromatyczny karbokation. Odłączenie protonu od atomu węgla do którego przyłączył się elektrofil pozwala na odtworzenie układu aromatycznego. Wśród reakcji tego typu możemy wymienić: nitrowanie, sulfonowanie, halogenowanie oraz reakcje alkilowania i arylowania Friedla-Craftsa.

Reakcja halogenowania węglowodorów aromatycznych zachodzi pod wpływem katalizatora, jakim jest kwas Lewisa – \(ACl_3\) w przypadku chlorowania, \(FeBr_3\) w przypadku bromowania. Obecność katalizatora oraz inny mechanizm odróżniają tę reakcję od halogenowania alkanów, które zachodzi rodnikowo, pod wpływem światła UV i bez udziału katalizatora. Przykładową reakcję pokazano na schemacie poniżej.

Nitrowanie węglowodorów aromatycznych polega na podstawieniu w miejsce atomu wodoru grupy nitrowej –NO2. Reakcja ta zachodzi pod wpływem tzw. mieszaniny nitrującej, składającej się ze stężonych kwasów siarkowego(VI) i azotowego(V) w proporcjach odpowiednich dla danego związku aromatycznego i pożądanej ilości wprowadzanych grup nitrowych. Elektrofilem w reakcji nitrowania jest jon nitroniowy, NO2+, który powstaje na skutek protonowania cząsteczki kwasu azotowego(V) (równanie 1), a następnie odłączenia cząsteczki wody (równanie 2)
\(H_2SO_4 + HNO_3 \Leftrightarrow HSO_4^- + H_2NO_3^+\) (1)
\(H_2NO_3^+ \Leftrightarrow H_2O + NO_2^+\) (2)
Przykładowe reakcje nitrowania przedstawiono na poniższym schemacie. U góry – prostą reakcję pojedynczego nitrowania benzenu, w której powstaje nitrobenzen, na dole reakcję otrzymywania tri nitrotoluenu z toluenu, w której wprowadzone zostają 3 grupy nitrowe.

Sulfonowanie to reakcja w której podstawieniu za atom wodoru ulega grupa sulfonowa, \(-SO_3H\). Elektrofilem w tej reakcji jest jon \(SO_3H^+\), który powstaje po przyłaczeniu protonu do cząsteczki tlenku siarki. Proces ten, opisany równianiem (3) zachodzi w oleum (roztworze \(SO_3\) w stężonym \(H_2SO_4\)), które jest wykorzystywane w reakcjach sulfonowania. Przykładową reakcję sulfonowania pokazano na schemacie poniżej.
\(H_2SO_4 + SO_3 \Leftrightarrow HSO_4^- + SO_3H^+ \)(3)

Alkilowanie Friedla-Craftsa polega na przyłączeniu podstawnika alkilowego do pierścienia aromatycznego. Elektrofilem w tej reakcji jest karbokation, powstały poprzez odłaczenie jonu X- od cząsteczki halogenku alkilowego, pod wpływem kwasu Lewisa (\(AlCl_3\) lub \(FeBr_3\)). Alternatywnie, karbokation może też powstać wskutek uprotonowania wiązania podwójnego w alkenie kwasem Bronsteda. Przykłady reakcji alkilowania Friedla-Craftsa za pomocą chlorku alkilowego z katalizatorem \(AlCl_3\) oraz alkenu w obecności silnego kwasu, \(H_3PO_4\), przedstawiono na schemacie poniżej.

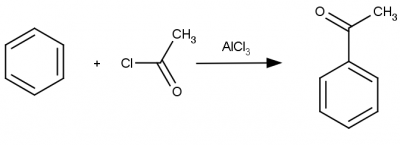
Reakcja acylowania Friedla-Crafsta jest analogiczna do reakcji alkilowania, różnica polega na tym, że wprowadzona zostaje grupa acylowa. Elektrofilem jest karbokation powstały po oderwaniu jonu chlorkowego od cząsteczki chlorku kwasowego przez kwas Lewisa. Przykładową reakcję acylowania – acetylowanie benzenu, przedstawiono na schemacie poniżej.