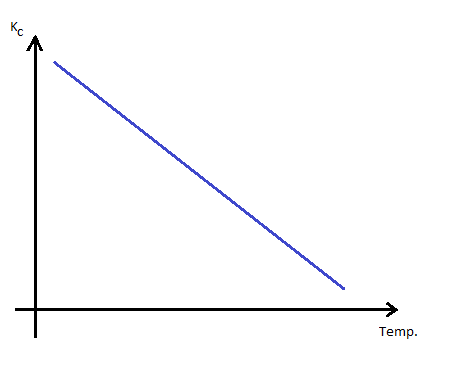
Określ efekt energetyczny reakcji i narysuj wykres zależności stałej równowagi w funkcji temperatury
Zapoznaj się z równaniem reakcji i danymi zebranymi w tabeli, a następnie określ efekt energetyczny reakcji i naszkicuj schematyczny wykres zależności stężeniowej stałej równowagi w funkcji temperatury.
CO(g) + 2H2(g) ↔ CH3OH(g)
|
Temp. |
298K |
400K |
600K |
800K |
|
Kc |
2,5×104 |
1,92 |
1,14×10-4 |
6,95×10-7 |
Odpowiedź eSzkola.pl
Michał
Ekspert eSzkola.pl
Analizując zmiany wartości stałej równowagi reakcji od temperatury można zauważyć, że ze wzrostem temperatury wartość Kc maleje, a zatem stężenie produktów maleje. Zgodnie z regułą przekory le Chateliera-Brauna, reakcja ta jest egzoenergetyczna.
Dzięki!
0
Znasz odpowiedź na to pytanie?
Wszystkie odpowiedzi (0)
Rozwiąż również:
- Na podstawie obliczeń określ samorzutność reakcji
- Zapoznaj się z wykresem i wyjaśnij, jak zmieni się wydajność reakcji
- Zapoznaj się z równaniem reakcji i określ słuszność poniższych stwierdzeń
- Zaprojektuj doświadczenia objaśniające wpływ czynników zewnętrznych na wydajność reakcji
- Oblicz wartość stężeniowej stałej równowagi K i stężenia równowagowe substratów