Oblicz stężenie fruktopiranozy znając ilość cząsteczek w roztworze
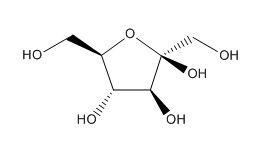
W roztworze wodnym fruktozy, na 1 mol cząsteczek cukru przypada 9,03×1024 cząsteczek wody. Oblicz stężenie procentowe tego roztworu w % wagowo-wagowych podając wynik z dokładnością do liczby całkowitej. Przyjmij w obliczeniach następujące wartości mas atomowych: MO = 16u, MH = 1u, MC = 12u. Poniżej przedstawiono wzór strukturalny fruktopiranozy.
Odpowiedź eSzkola.pl
Michał
Ekspert eSzkola.pl
Obliczenie mas molowych wody oraz fruktozy:
Mfruktoza = 6x12+1x12+6x16 = 180 g/mol
MH2O = 1x16+1x2 = 18 g/mol
Obliczenie jaką część mola stanowią cząsteczki wody w roztworze:
Obliczenie masy wody i fruktozy:
mH2O = n×M = 15x18 = 270 g
mfruc = n×M = 1x180 = 180 g
Podstawienie danych do wzoru:
c% (w/w) = 180/180+270 ×100% = 40%
Odpowiedź: Stężenie procentowe otrzymanego roztworu fruktozy wynosi 40%.
Dzięki!
0
Znasz odpowiedź na to pytanie?
Wszystkie odpowiedzi (0)
Rozwiąż również:
- Oblicz stężenie molowe roztworu chlorowodoru
- Oblicz liczbę moli hydratu siarczanu(VI) magnezu potrzebną do przygotowania roztworu
- Oblicz ilość mleczanu etakrydyny porzebną do przygotowania roztworu
- Przygotowywanie etanolowego roztworu kwasu salicylowego
- Oblicz masę pięciowodnego siarczanu(VI) miedzi potrzebną do przygotowania roztworu